The ClpX Chaperone and Super-Resolution Imaging – a promising toolbox to explore Staphylococcus aureus cell division and the killing mechanism of β-lactam antibiotics
Ph.d.-student: Camilla Jensen
Thesis forsvaret: 27. april 2021
BAGGRUND
Du har sikkert spist penicillin for at kurere halsbetændelse eller andre bakterielle infektioner - men har du nogensinde overvejet hvordan penicillin faktisk virker?
For 100 år siden døde de fleste mennesker af lungebetændelse, tuberkulose og andre bakterielle infektioner. Derfor er opdagelsen af penicillin og andre antibiotika et af de største gennembrud i lægevidenskabens historie. Brugen af penicillin har reddet millioner (måske milliarder!) af liv, men vi ved stadig ikke, hvordan dette ”wonder-drug” dræber bakterier.
I vores forskningsgruppe arbejder vi med bakterien Staphylococcus aureus (S. aureus), som lever naturligt på huden og i næsen hos mennesker og dyr. Samtidig er bakterien en af de hyppigste årsager til både mindre alvorlige infektioner i huden og livstruende infektioner i fx hjerteklapper og knogler. Normalt dræbes stafylokok-bakterien af penicillin, men ved et tilfælde fandt vi en S. aureus mutant, som meget overraskende kun var i stand til at vokse frem og formere sig, når vi tilsatte penicillin til dens vækstmedie.
FORMÅL
Det er første gang, man har observeret at penicillin kan hjælpe en bakteriel mutant med at formere sig. Vi fremsatte derfor hypotesen at denne stafylokok mutant kunne være det uventede værktøj, der kan være med til at løse mysteriet om, hvordan penicillin virker.
RESULTATER
Det første vi ville undersøge var, hvorfor mutanten formerer sig dårligt uden penicillin. Bakterier er meget små – de er typisk mindre end 1/1000 af en millimeter. Når vi vil studere bakterier, har vi derfor brug for kraftige mikroskoper og indenfor det seneste årti er der udviklet avancerede mikroskoper, som for første gang har gjort det muligt at kigge helt ind i bakterien og se de mindste detaljer. Med denne type af mikroskoper kunne vi se, at mutanten har mistet evnen til at kontrollere aktiviteten af nogle enzymer (”autolysiner”), der nedbryder cellevæggen. Disse enzymer aktiveres normalt kun når bakterien er klar til at dele sig i to, dvs. når den har bygget en cellevæg tværs gennem cellen. I mutanten så vi derimod, at autolysinerne blev aktiveret for tidligt, hvilket resulterede i, at mutanten blev sprængt i stykker, fordi den umodne cellevæg ikke var i stand til at modstå det indre pres (Figur, top). Det næste trin var at undersøge, hvordan penicillin hjælper mutanten med at formere sig. Når vi tilsatte pencillin, kunne vi se at mutanten var i stand til at lave en moden cellevæg før autolysinerne blev aktiveret. Penicillin hjælper altså mutanten med at formere sig ved at forsinke autolysinerne og dermed forhindre at mutanten brister (Figur, bund).
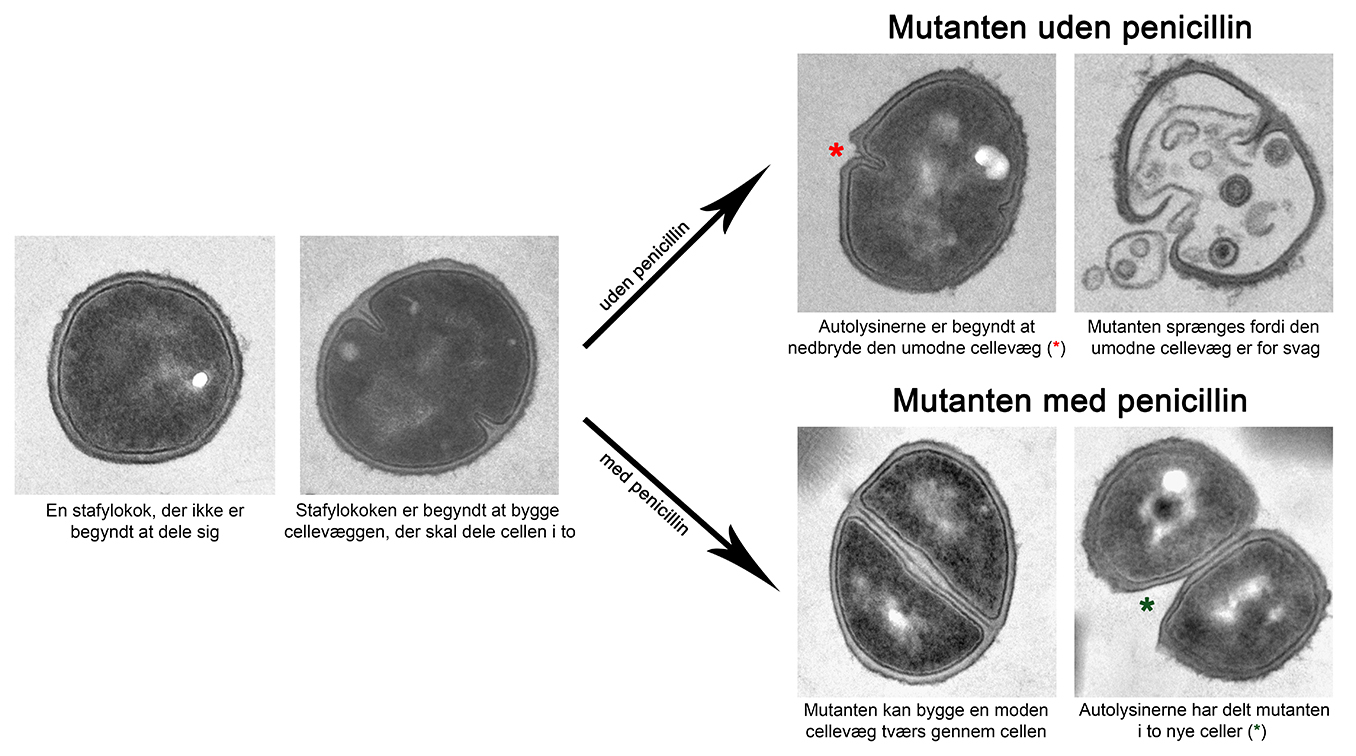
Vores data peger derfor på at penicillin under normale omstændigheder hæmmer aktivering af autolysinerne, der er vigtige for at cellen kan dele sig og dermed forhindrer stafylokok-bakterien i at formere sig. Med dette studie, er vi kommet et vigtigt skridt tættere på at forstå, hvordan penicillin dræber bakterier.
FREMTIDSPERSPEKTIVER
Hvert år pådrager mellem 60.000 og 100.000 danskere sig en bakterieinfektion i forbindelse med indlæggelse på et hospital, og den stigende forekomst af antibiotikaresistente bakterier udgør derfor en særlig trussel på hospitalerne. I Danmark er MRSA (methicillin-resistente S. aureus) en af de hyppigste årsager til livstruende infektioner i svækkede patienter. Disse infektioner er svære at behandle, fordi bakterierne er resistente overfor netop den type antibiotika, som bakterierne bedst behandles med – nemlig penicillin.
Det kan dog blive muligt at behandle MRSA infektioner med penicillin igen – men det krævet at vi kan identificere hjælpestoffer, der gengiver MRSA deres følsomhed overfor penicillin. I dette studie har vi yderligere fundet ud af at vores stafylokok-mutant kan bruge som et redskab til at finde sådanne hjælpestoffer. Ved at bruge mutanten, var vi i stand til specifik at udvælge stoffer, der gør MRSA følsomme over for pencillin igen i et bibliotek med mere end 50.000 tilfældige stoffer. Disse stoffer har potentiale til på sigt at kunne booste penicillins effekt mod de resistente MRSA-bakterier og på den måde gøre behandlingen mere effektiv.
